Tính chất hóa học chung của kim loại & Bài tập áp dụng
Như chúng ta đã biết, kim loại chiếm tới 80% trong tổng số các nguyên tố hóa học và được ứng dụng rất nhiều trong đời sống và sản xuất. Vì thế, để có được hiệu quả trong việc sử dụng kim loại thì chúng ta cần hiểu được tính chất hóa học chung của kim loại. Vậy kim loại gồm có những tính chất hóa học nào?

Cấu tạo, phân loại và vị trí của kim loại
Kim loại có tên tiếng Anh là Metal và là nguyên tố hóa học, nó tạo ra ion + hay còn gọi là cation và các mạng liên kết kim loại. Kim loại thuộc nhóm nguyên tố do độ ion hóa và đặc tính liên kết với á kim và phi kim.
Cấu tạo của kim loại
Kim loại có cấu tạo từ tinh thể và nguyên tử. Cụ thể:
- Cấu tạo tinh thể: Trừ Hg ở thể lỏng ở nhiệt độ thường, thì các kim loại ở thể rắn và chúng có cấu tạo tinh thể. Hạt nhân liên kết rất kém với các e hóa trị, do đó dễ tách khỏi nguyên tử và các e di chuyển tự do trong mạng tinh thể kim loại. Mạng tinh thể kim loại bao gồm: lập phương tâm khối như Na, Li, K,… và lập phương tâm diện như Cu, Au, Ag,..; lục phương như Mg, Be, Zn,…
- Cấu tạo nguyên tử: Nguyên tử của đa số nguyên tố kim loại có rất electron ở lớp ngoài cùng (thường chỉ có 1, 2 hoặc 3 e)
Vị trí của kim loại trong bảng tuần hoàn
Trong bảng tuần hoàn các nguyên tố hóa học, kim loại có vị trí ở nhóm IA (trừ H), IIIA (trừ Bo), nhóm IIA và 1 phần trong nhóm VIA, VA, IVA. Trong các nhóm B từ nhóm IB – VIIIB . Những kim loại phóng xạ bao gồm họ actini và Lantan.
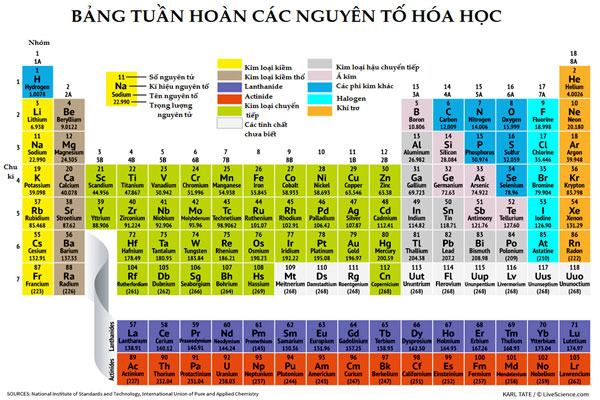
Phân loại kim loại
Hiện kim loại được phân thành 4 loại sau:
- Kim loại cơ bản: Là kim loại dễ dàng phản ứng với môi trường bên ngoài, tạo nên sự oxy hóa, ăn mòn..
- Kim loại hiếm: Ngược lại với nhóm kim loại cơ bản, những kim loại này ít bị ăn mòn bởi axit, oxy. Và giá trị của chúng cũng cao hơn nhiều so với các kim loại còn lại như bạch kim, bạc, vàng,..
- Kim loại đen: Là những kim loại có chứa Fe và có từ tính như gang, thép,.. kim loại đen rất phổ biến và có thể tái chế được nhiều lần.
- Kim loại màu: Là những kim loại còn lại không phải kim loại đen, chúng có màu đặc trưng riêng và được sản xuất từ quặng màu thứ sinh hoặc nguyên sinh. Kim loại mày có thể chống ăn mòn tốt hơn kim loại đen.
Tính chất vật lý của kim loại
Kim loại có màu sắc ánh kim, có tính cứng và có thể gia công, dát mỏng thành nhiều hình thù đa dạng. Nhờ các ion nên chúng có thể dẫn điện rất tốt và nó còn có từ tính, có điểm nóng chảy cao.
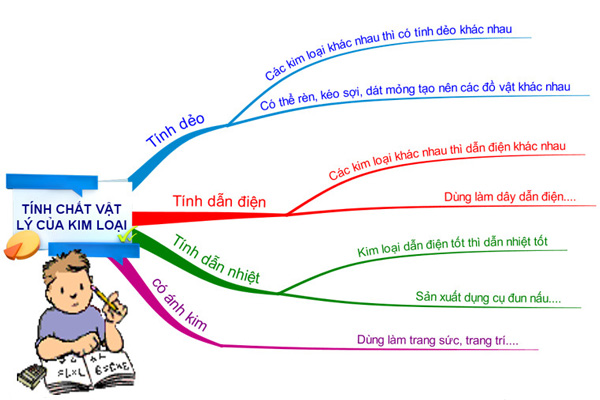
Tính giãn nở vì nhiệt cũng là tính chất đặc trưng của kim loại. Khi gặp nhiệt độ cao, kim loại có xu hướng giãn ra, còn khi gặp lạnh chúng thường co lại. Hầu hết kim loại đều ở thể rắn ở nhiệt độ thường trừ copernix và thủy ngân ở thể lỏng.
||Xem thêm: Sự giãn nở vì nhiệt của chất rắn là gì? – Bài tập áp dụng
Về cơ tính, kim loại và những hợp kim của nó có tính dẻo, đàn hồi, độ bền kéo và độ bền nén nhất định. Tùy thuộc vào cấu tạo mà mỗi kim loại sẽ có mức độ lý tính, cơ tính cao hoặc thấp hơn nhau.
Kim loại được ứng dụng nhiều trong gia công như rèn, đúc, cắt, dập, đột, hàn mài,… Đặc biệt, với công nghệ nhiệt luyện thì độ cứng kim loại và hợp kim có thể thay đổi nhằm tạo ra nhiều loại vật liệu khác nhau.
4 tính chất hóa học chung của kim loại
Dưới đây là những tính chất hóa học đặc trưng của kim loại:

Tác dụng với Oxi
Ở nhiệt độ thường hoặc nhiệt độ cao, đa số các kim loại đều tác dụng với oxi tạo thành oxit. Tuy nhiên, cũng có một số kim loại không phản ứng với oxi là Ag, Au, Pt,… VD:
2O2 + 3Fe → Fe3O4
3O2 + 4Cr → 2Cr2O3
Tác dụng với phi kim khác
Phi kim là các nguyên tố nằm bên phải của bảng tuần hoàn, nó có tính chất không dẫn điện trừ C, graphit. Đa số các kim loại phản ứng với phi kim ở nhiệt độ cao sẽ tạo thành muối. VD:
2S + 2Al → Al2S3
3Cl2 + 2Fe → 2FeCl3
Tác dụng với dung dịch axit
Khi kim loại phản ứng với dung dịch axit sẽ tạo ra khí Hidro và muối. Trong trường hợp chất phản ứng là axit nóng, đặc thì phản ứng sẽ tạo ra muối Nitrat và các khí như NO2, N2, NO, hoặc muối Sunfat và các khí như H2S, SO2. VD:
6HCl + 2Al → 2AlCl3 + 3H2
Mg + 2HNO3 → H2 + Mg(NO3)2
A + HNO3 → A(NO3)n + {NO, NO2, N2, NH4NO3, N2O) + H2O ( điều kiện H2SO4 đặc nóng)
A + H2SO4 → M2(SO4)n + {S, SO2, H2S} + H2O
Tác dụng với dung dịch muối
Kim loại hoạt động mạnh phản ứng với muối của kim loại yếu sẽ tạo ra muối mới và kim loại mới. Trừ Ba, K, Na,… bởi trong điều kiện thường, kim loại kiềm thổ và kim loại kiềm sẽ tan trong nước. VD:
Fe + CuSO4 → FeSO4 + Cu
2Al + 3FeSO4 → 3Fe + Al2(SO4)3
Mg + FeCl2 → Fe + MgCl2
Những kim loại mạnh bao gồm Na, K, Ca, Ba, Sr,… trong điều kiện thường có thể dễ dàng tác dụng với nước để tạo ra dung dịch bazơ.
VD: nH2O + A →A(OH)n + H2
Kim loại trung bình gồm Al, Fe, Mg, Zn,… trong điều kiện nhiệt độ cao phản ứng với hơi nước tạo ra khí hidro và oxit kim loại.
VD: 3Fe + 4H2O hơi → Fe3O4 + 4H2
Bài tập áp dụng tính chất hóa học của kim loại
Dưới đây là một số dạng bài tập áp dụng tính chất hóa học của kim loại thường gặp
Dạng bài tập kim loại tác dụng với phi kim
Ví dụ: Cho 1.1 gam hỗn hợp bột Fe và Al tác dụng đủ với 1,28 gam S. Hãy tính khối lượng của mỗi kim loại trong hỗn hợp đầu.

Dạng kim loại tác dụng với axit loãng
Ví dụ: Cho 8,85 gam hỗn hợp X gồm Zn, Mg vào dung dịch HCl dư thu được 3,36l H2 ở đktc. Phần chất rắn không phản ứng với HCl được rửa sạch và đốt cháy trong oxi tạo ra 4g chất bột màu đen. Hãy tính % khối lượng của Zn, Cu, Mg.
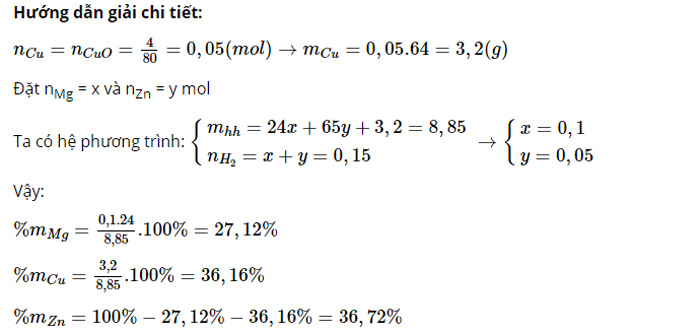
Dạng bài kim loại tác dụng với axit đặc
Ví dụ: Hòa tan 9,6 gam kim loại R bằng dung dịch axit H₂SO₄, đặc, nóng (dư). Sau phản ứng sinh ra 3,36 lít khí SO₂ (sản phẩm khử duy nhất, ở đktc). Tìm kim loại R?
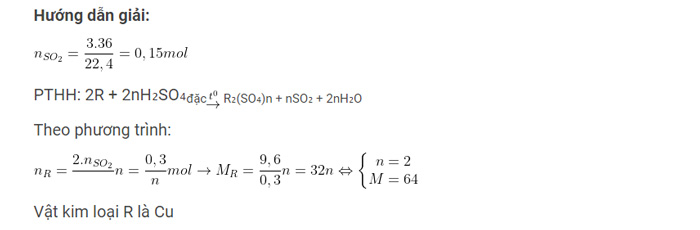
Dạng bài tập kim loại tác dụng với muối
Ví dụ: Cho 8,4 gam bột Fe vào 1l dung dịch A có chứa 0.2M AgNO₃ và 0,1M CuSO₄. Sau phản ứng thu được chất rắn B (phản ứng xảy ra hoàn toàn), vậy khối lượng của B là bao nhiêu?
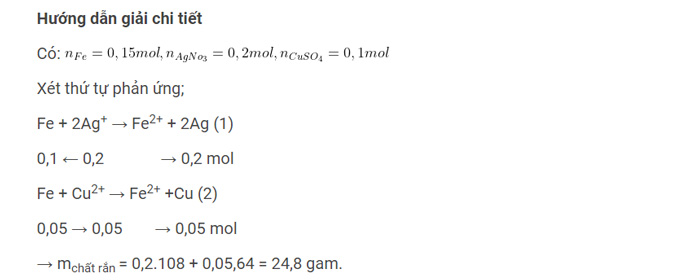
Bài viết trên đây chúng tôi đã cung cấp cho các bạn những kiến thức cơ bản về tính chất hóa học chung của kim loại cũng như các dạng bài tập thường gặp. Hy vọng bài viết của giamayruaxe.net đã giúp bạn học tập và bổ trợ được nhiều kiến thức bổ ích.
Nguồn bài viết: Tính chất hóa học chung của kim loại & Bài tập áp dụng appeared first on Giá máy rửa xe.
source https://giamayruaxe.net/tinh-chat-hoa-hoc-chung-cua-kim-loai/
Nhận xét
Đăng nhận xét